Mapa Mental: Entenda Química e Suas Ligações de Forma Simples
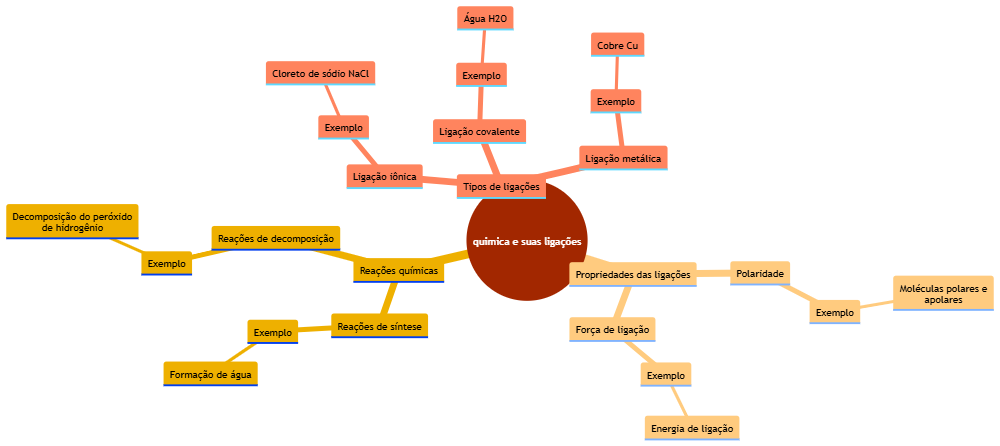
Nesta postagem, apresentamos um mapa mental sobre quimica e suas ligaçoes gerado automaticamente. Abaixo você encontra o diagrama e o texto de apoio para cada tópico.
📝 Texto de Apoio para Cada Tópico
body {
font-family: Arial, sans-serif;
line-height: 1.6;
margin: 20px;
}
h1, h2, h3 {
color: #2C3E50;
}
Química e Suas Ligações
Este tópico aborda a importância das ligações químicas, que são fundamentais para a formação de moléculas e compostos. Em sala de aula, é essencial explicar como essas ligações influenciam as propriedades das substâncias e suas reações.
Tipos de Ligações
As ligações químicas podem ser classificadas em três tipos principais: iônica, covalente e metálica. É importante demonstrar como cada tipo se forma e quais são as características que os diferenciam.
Ligação Iônica
A ligação iônica ocorre quando há transferência de elétrons entre átomos, resultando na formação de íons. Esses íons se atraem devido à força eletrostática. Em sala de aula, é interessante usar exemplos como o cloreto de sódio (NaCl) para ilustrar como esses compostos se formam.
Exemplo: Cloreto de Sódio (NaCl)
O NaCl é formado pela reação entre sódio (Na) e cloro (Cl), onde o sódio perde um elétron e o cloro ganha, resultando em íons que se atraem, formando um sólido cristalino.
Ligação Covalente
A ligação covalente se forma quando dois átomos compartilham elétrons. Essa ligação é comum entre não-metais. Em sala de aula, usar a água (H2O) como exemplo ajuda a entender como dois átomos de hidrogênio compartilham elétrons com um átomo de oxigênio.
Exemplo: Água (H2O)
A molécula de água é formada pela ligação entre dois átomos de hidrogênio e um átomo de oxigênio, onde os elétrons são compartilhados, resultando em uma molécula polar.
Ligação Metálica
A ligação metálica envolve a partilha de elétrons por um conjunto de átomos, formando uma “nuvem” de elétrons que permite a condução de eletricidade e calor. Usar cobre (Cu) como exemplo pode ajudar os alunos a entender a maleabilidade e a condutividade dos metais.
Exemplo: Cobre (Cu)
No cobre, os elétrons livres permitem que os átomos de cobre se movam e se reorganizem, dando ao metal suas propriedades características.
Propriedades das Ligações
As propriedades das ligações químicas, como polaridade e força de ligação, influenciam o comportamento das substâncias. Discutir essas propriedades em sala de aula pode ajudar os alunos a prever como diferentes compostos interagem.
Polaridade
A polaridade refere-se à distribuição desigual de elétrons em uma molécula, resultando em uma carga elétrica parcial. Em aula, é útil discutir moléculas polares e apolares para ilustrar como a polaridade afeta a solubilidade e outras propriedades.
Exemplo: Moléculas Polares e Apolares
Água é uma molécula polar, enquanto o óleo é uma molécula apolar. Essa diferença de polaridade explica por que água e óleo não se misturam.
Força de Ligação
A força de ligação é uma medida da energia necessária para romper uma ligação química. Discutir a energia de ligação em sala de aula ajuda os alunos a entenderem a estabilidade e reatividade das substâncias.
Exemplo: Energia de Ligação
A energia de ligação varia entre diferentes tipos de ligações, sendo geralmente mais alta em ligações iônicas e covalentes do que em ligações metálicas.
Reações Químicas
As reações químicas são processos em que substâncias se transformam em outras. É crucial abordar as diferentes classes de reações, como síntese e decomposição, para que os alunos compreendam como as ligações são rompidas e formadas.
Reações de Síntese
Reações de síntese envolvem a combinação de duas ou mais substâncias para formar uma nova. Utilizar a formação de água como exemplo ajuda a ilustrar esse conceito.
Exemplo: Formação de Água
A formação de água ocorre quando o hidrogênio e o oxigênio se combinam, resultando em uma nova substância.
Reações de Decomposição
Reações de decomposição ocorrem quando uma substância se divide em duas ou mais substâncias mais simples. Em sala de aula, a decomposição do peróxido de hidrogênio é um exemplo prático e visual.
Exemplo: Decomposição do Peróxido de Hidrogênio
O peróxido de hidrogênio (H2O2) se decompõe em água e oxigênio, uma reação que é tanto interessante quanto educativa para os alunos.



